エルドハイム・チェスター病Ver.1 2026/1
Erdheim-Chester disease:ECD
はじめに
エルドハイム・チェスター病(Erdheim-Chester disease:ECD)は、まれな非ランゲルハンス細胞性組織球性腫瘍の1つで、活性化したCD68陽性・CD163陽性、CD1a陰性・CD207陰性の組織球が臓器に浸潤する疾患である。骨痛、尿崩症、心・肺・腎障害など多彩な症状を示す。1930年にChesterとErdheimが特徴的な骨病変を有する黄色肉芽腫症として2例を報告し、1972年にJaffeが泡沫状組織球の浸潤を伴う長管骨の骨硬化像を特徴とする疾患をErdheim-Chester disease:ECDと名付けた。2012年に約半数の例でBRAF V600E変異を認めることが明らかとなり、2016年のWHO分類で「組織球性および樹状細胞性腫瘍」に追加された。2016年のHistiocyte Societyによる組織球症の新しい分類では、Langerhans cell histiocytosis(LCH)と同じL-Groupに分類されている1)。小児の多臓器型の黄色肉芽腫、特に後述するBRAF V600E変異陽性例をECDに含める考えもあるが、いまだコンセンサスは得られていない2)。
疫学
40代~60代に多く、診断時の平均年齢は50歳前後で、男性に多く男女比は3:1と報告されている3,4)。小児期発症は稀である。日本では、日本血液学会疾患登録の集計によると、年間10例程度の新規診断例がある。
病因
2012年にECDの病変組織にBRAF V600E変異を認めることが報告され5)、現在ではMAPキナーゼ経路またはPI3K-AKT経路の遺伝子の活性化変異に起因する骨髄性腫瘍と考えられている。BRAF V600E変異を約半数に、MAP2K1変異を約1/4に、KRASまたはNRAS変異を約10%に、CSF1RやNTRK、ALKなどのキナーゼ受容体の変異を約5%、PI3K-AKT経路の遺伝子変異を約3%に認める(図1)6)。BRAF V600E変異陽性ECDにおいて、CD34陽性の造血幹細胞/前駆細胞、単球、骨髄系樹状細胞に変異アレルが同定されており、ECDには潜在的な起源細胞が複数存在することが示唆されている7)。
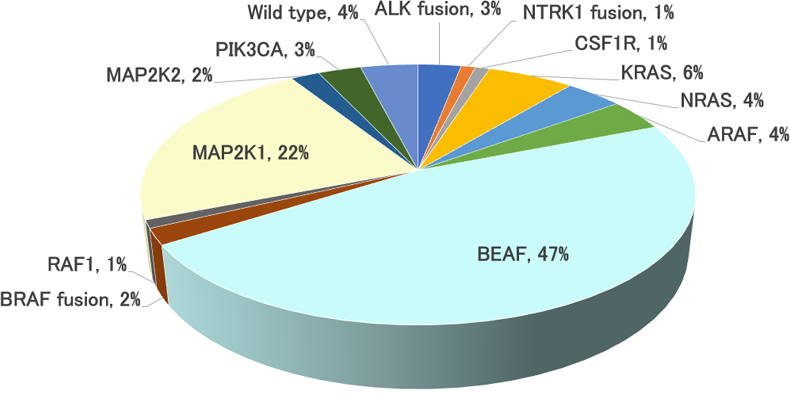
図1.Erdheim-Chester病の遺伝子変異
(N=100, 文献6を改変)
浸潤臓器と臨床症状
様々な臓器に浸潤し多彩な臓器症状を呈する。浸潤臓器の割合を図2に示す3)。以下に、頻度の高い浸潤臓器と症状を記述する3,4,8)。
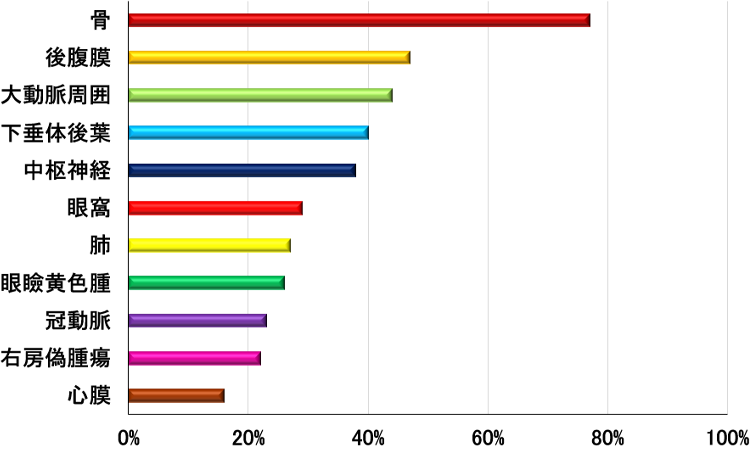
図2.Erdheim-Chester病の浸潤臓器
(N=769, 文献5より作図)
-
骨
約80%の例に、長管骨、特に大腿骨や脛骨、腓骨の骨幹端部に両側対称性の特徴的な骨硬化像がみられる。骨痛を認めることが多いが、1/3の例は無症状である。
-
心大血管
CTやMRI検査で50~70%の例に様々な病変を認める。約半数の例で、CT検査で、胸部/腹部大動脈およびその分枝の血管周囲に軟部組織が鞘のように取り巻く、“coated aorta”と呼ばれる特徴的な所見がみられる。通常これだけでは無症状であるが、腎動脈周囲の病変により高血圧をきたすことがある。心膜浸潤(15‐20%)による心嚢液貯留や、心筋浸潤(20-25%)による右房偽腫瘍もしばしば認める。20%以上の例で冠動脈病変を認め、冠動脈狭窄や心筋梗塞を合併することがある。
-
後腹膜病変
約半数の例で、CT検査で、腎臓周囲を肥厚した軟部組織が取り巻く、“hairy kidney”と呼ばれる特徴的な所見がみられる。腎臓周囲の浸潤が腎盂や尿管にまで広がり両側水腎症をきたし、腎瘻造設術やステント留置が必要になることがある。長期にわたる腎臓周囲の病変により、腎臓萎縮、腎不全をきたすことがある。副腎にまで病変が広がる例もある。
-
肺
ほとんどが無症状であるが、高解像度CTで約30%の例に小葉間隔肥厚、すりガラス陰影、中心小葉陰影などが見られ、間質性肺炎の像を呈する。LCHとは異なり、喫煙との関連は報告されていない。胸膜浸潤を呈することもある。
-
下垂体
40‐70%の例に認める。なかでも、中枢性尿崩症は約30%の例に認め、ECDの診断より数年以上前に先行して発症していることがある。その他、成長ホルモン、中枢性の甲状腺機能低下症や性腺機能不全、副腎不全などの下垂体前葉機能不全を15‐30%に認める。MRI検査で下垂体および下垂体茎への浸潤が見られる。ホルモン分泌不全は通常不可逆的である。
-
中枢神経
40%近くの例に認められる。後頭蓋窩の脳実質や硬膜の造影効果を伴う腫瘍性病変が多い。10‐20%に脳幹や小脳に造影効果のない非腫瘍性の神経変性様病変を認める。脳底動脈への浸潤により、虚血性脳卒中をきたすことがある。病変部位により、小脳症状(運動失調や構音障害など)、錐体路症状、けいれん、頭痛、末梢神経障害、認知障害、情緒障害などをきたす。
-
眼
25~30%の例に認める。眼球突出、眼痛、動眼神経麻痺、視力低下などを呈する。
-
皮膚
20~30%の例に認める。ECDの初期症状として現れることが多い。眼瞼周囲の黄色斑として現れる眼瞼黄色腫が最も多いが、顔面、頸部、腋窩、体幹、股間などに黄褐色の丘疹または斑が現れることもある。また、皮下結節または肉芽腫、環状病変として現れることもある。
-
- その他、肝臓や胆管、脾臓、リンパ節、骨髄、歯肉、腸管に病変をきたすことがある。
- 血液検査では、ほとんどの例で炎症反応の上昇を認める。
- BRAF V600E変異陽性例は、大動脈病変、心膜病変、右房偽腫瘍、中枢神経病変を認める率が有意に高い。
診断と検査
疾患が稀で、多彩な症状を呈することから診断は容易ではなく、発症から診断に至るまで数年が経過している例も稀ではない。特徴的な臨床および画像所見(特に下肢の左右対称性の骨硬化、coated aorta、hairy kidney、眼瞼黄色腫)と病変組織の病理学的所見を統合して診断される。
病変検索にはPET/CTが極めて有用であり、下肢骨も含めた全身の撮影が全例に推奨される。中枢病変や心血管病変の検出のために造影MRI検査も全例に必要である。その他、症状や臓器障害に基づいて必要に応じ、副鼻腔や胸部、腹部、骨盤の造影CT、下垂体や眼窩、脊椎の造影MRI、肺の高解像度CT、心臓や腎動脈の超音波検査、骨シンチ、肺機能検査、下垂体ホルモン検査、骨髄検査などを行う。病変組織の遺伝子変異解析は、診断の補完および標的治療の選択に有用であり、必須である。より安全に生検可能な病変から、質・量ともに十分な病変組織を採取することが重要である。
病理学的検査で、病変部には一般に泡沫状組織球が浸潤し線維化や黄色肉芽腫に取り囲まれている。リンパ球や形質細胞、好中球の浸潤がみられることがある。核がリング上に配置された巨大組織球(Touton型多核巨細胞)は特徴的な所見であるが、常に見られるとは限らない。ECDの組織球はCD68、CD163、FXIIIa陽性、CD1a陰性、CD207陰性である。病理学的に黄色肉芽腫と鑑別することは困難である。典型的な病理学的所見が得られないこともあり、その場合には、臨床および画像所見、病変の遺伝子解析所見(チロシンキナーゼ受容体/MAPキナーゼ経路/PI3K-AKT経路遺伝子の活性化変異)と合わせて診断する必要がある。
ECDと同一クローから発生したと考えられる他の骨髄性腫瘍を伴うことがある。ECDの20%にLCHが合併する。LCHと診断されている例において、LCHにはみられない前述のECDに特徴的な所見を認めた場合は、LCHにECDが合併したmixed histiocytosisを考慮すべきで9)、確認のために複数個所の生検が必要である。また、ECDの10%に慢性骨髄単球性白血病、骨髄異形成症候群などの骨髄性悪性腫瘍を伴うと報告されており注意を要する10)。
治療と予後
骨病変のみで無症状の例は無治療経過観察も可能であるが、それ以外のほとんどの例で全身治療が必要である。これまで、ステロイドや放射線など様々な治療が試みられてきたが、これらは有効性に乏しく推奨されない。2021年のNCCNガイドラインでは、BRAF V600E変異陽性例にはBRAF阻害薬を、それ以外のMAPキナーゼ経路の遺伝子変異陽性例または変異が検出されない例にはMEK阻害薬を推奨している。これらの分子標的薬が使えない場合にはクラドリビンまたはインターフェロン-α、シロリムス+プレドニゾロン、メソトレキセート、IL-1阻害薬を、ALK fusionやNTRK fusionなど特定のチロシンキナーゼ受容体の変異が検出された場合にはその阻害薬を推奨している11)。日本では、2023年11月に世界に先駆けて標準的な治療が困難なBRAF遺伝子変異を有する進行・再発性の組織球性腫瘍にBRAF阻害薬(ダブラフェニブ)とMEK阻害薬(トラメチニブ)の併用療法が保険承認され、その効果が期待される。分子標的療法は高い有効性が報告されているが、薬剤を中止すると約75%の例が早期に再燃する12)ため、今後、分子標的薬の適切な投与期間、投与中止可能性などを検証していく必要がある。
海外では診断と治療の進歩により、5年生存率は80%以上に改善してきており、予後不良因子として高齢、中枢神経、肺、後腹膜病変が挙げられている13)。
参考文献
- Emile JF, Abla O, Fraitag S, et al. Revised classification of histiocytoses and neoplasms of the macrophage-dendritic cell lineages. Blood. 2016;127:2672-2681.
- Picarsic J, Pysher T, Zhou H, et al. BRAF V600E mutation in Juvenile Xanthogranuloma family neoplasms of the central nervous system (CNS-JXG): a revised diagnostic algorithm to include pediatric Erdheim-Chester disease. Acta Neuropathol Commun. 2019; 7: 168.
- Haroche J, Cohen-Aubart F, Amoura Z. Erdheim-Chester disease. Blood. 2020;135:1311-1318.
- Goyal G, Heaney ML, Collin M, et al. Erdheim-Chester disease: consensus recommendations for evaluation, diagnosis, and treatment in the molecular era. Blood. 2020;135:1929-1945.
- Haroche J, Charlotte F, Arnaud L, et al. High prevalence of BRAF V600E mutations in Erdheim-Chester disease but not in other non-Langerhans cell histiocytoses. Blood. 2012;120: 2700-2703.
- Durham BH, Lopez Rodrigo E, Picarsic J, et al. Activating mutations in CSF1R and additional receptor tyrosine kinases in histiocytic neoplasms. Nat Med. 2019;25:1839-42.
- Milne P, Bigley V, Bacon CM, et al. Hematopoietic origin of Langerhans cell histiocytosis and Erdheim-Chester disease in adults. Blood. 2017; 130: 167-175.
- Pegoraro F, Papo M, Maniscalco V, et al. Erdheim-Chester disease: a rapidly evolving disease model. Leukemia. 2020;34:2840-2857.
- Bonometti A. The triptych of mixed histiocytosis: a systematic review of 105 cases and proposed clinical classification. Leuk Lymphoma. 2021; 62: 32-44.
- Papo M, Diamond EL, Cohen-Aubart F, et al. High prevalence of myeloid neoplasms in adults with non-Langerhans cell histiocytosis. Blood. 2017; 130: 1007-1013.
- Go RS, Jacobsen E, Baiocchi R, et al. Histiocytic Neoplasms, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network. 2021;19:1277-1303.
- Cohen-Aubart F, Emile J-F, et al. Targeted therapies in 54 patients with Erdheim-Chester disease, including follow-up after interruption (the LOVE study). Blood. 2017;130:1377-1380.
- Cohen-Aubart F, Emile JF, Carrat F, et al. Phenotypes and survival in Erdheim-Chester disease: results from a 165-patient cohort. Am J Hematol. 2018; 93: E114-E117.