ロサイ・ドルフマン病Ver.1 2026/1
Rosai-Dorfman-Destombes disease:RDD
はじめに
ロサイ・ドルフマン病(Rosai-Dorfman-Destombes disease:RDD)は、まれな非ランゲルハンス細胞性組織球性腫瘍の1つで、活性化し組織球が臓器に浸潤する疾患である。無痛性の、主に両側頚部の、リンパ節腫脹が特徴的であり、疾患の特徴を表した「巨大リンパ節腫脹 を伴う洞組織球症(Sinus Histiocytosis with Massive Lymphadenopathy: SHML)」の別名で呼ばれることもある。1965年のDestombesらの報告に始まり、1969年のRosaiとDorfmanらの報告で疾患概念が確立した1)。2016年のHistiocyte Societyによる組織球症の新しい分類では、R-Groupとして独立して分類されている2)。2022年に改訂された第5版WHO分類では、新たに「組織球系腫瘍および樹状細胞性腫瘍」に分類された3)。本疾患は、組織球性腫瘍の中でも希少疾患であり、文献は総説1,4,5)と後方視的ケースシリーズ6,7,8,9,10)の他は、症例報告に限られる。
疫学
発症頻度は、米国では20万人に1人で年間100例が新規に診断されるが、本邦では患者は少なく新規診断例は年間10例以下である。アフリカ系人種に多く、アジア系では女性の皮膚病変の報告がある。発症年齢の中央値は20.6歳で、性別では1.4:1と男性にやや多い。
病態
RDDの約50%で体細胞変異が同定されており、CSF1R, KRAS, NRAS, MAP2K1などのキナーゼ遺伝子の活性型変異が知られる(図1)1,7,8,9,10)。このうちMAPキナーゼ経路に関与するMAP2K1とKRASの変異が最多で、両者を合わせるとRDD全体の1/3を占める。BRAF変異の報告もあるが、ランゲルハンス細胞組織球症(LCH)やErdheim-Chester病(ECD)と比較するとごくわずかである。
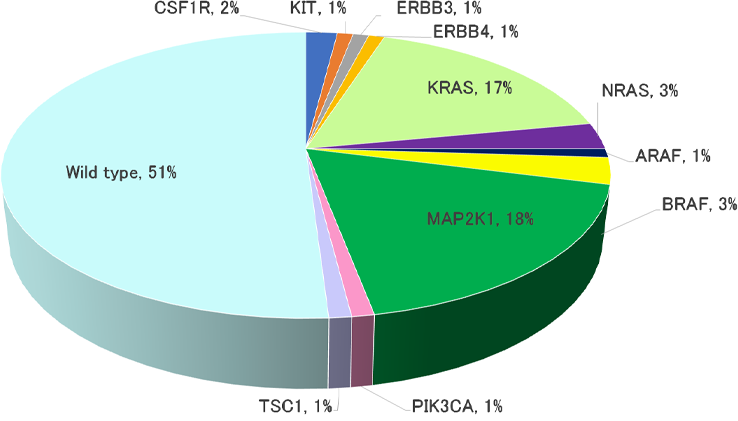
図1 Rosai-Dorfman-Destombes病の遺伝子変異
(N=115, 文献1,7,8,9,10より作図)
RDDの一部は遺伝/先天性、自己免疫疾患、悪性腫瘍との関連が報告されている。家族性RDDには、SLC29A3遺伝子の生殖細胞系列変異によるH症候群(ファイサラバード症候群)、TNFRSF6遺伝子の変異によるFAS欠損症、自己免疫性リンパ増殖症候群(ALPS)関連のRDDが含まれる。RDDの約10%は自己免疫疾患を併発し、全身性エリテマトーデスとの合併が多い。特発性若年性関節炎や自己免疫性溶血性貧血と関連するとの報告もある。リンパ腫の既往のある患者に発生することがあり、濾胞性リンパ腫や結節性リンパ球優位型ホジキンリンパ腫の合併が多い。明細胞肉腫、骨髄異形成症候群、前駆B細胞急性リンパ性白血病、他の組織球性腫瘍(LCH、ECD、悪性組織球性腫瘍)と、同時発生もしくは続発して発生する例もある。
病型と臨床症状
リンパ節限局型とリンパ節外型に大別される。浸潤臓器の頻度を図に示す(図2)5)。
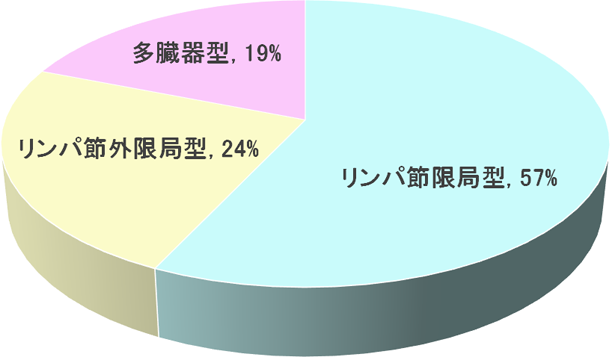
図2 病型別の頻度(文献1より作図)
リンパ節限局型 (約60%)
両側性の巨大な無痛性の頚部リンパ節腫脹が特徴的である。縦隔、腋窩、鼠蹊部のリンパ節腫脹を伴う場合もあるが、後腹膜のリンパ節腫脹は稀である。間欠的な発熱、盗汗、体重減少を伴う場合もある。
リンパ節外型 (約40%)
節外型RDDの病変部位は多岐にわたる。全体の20%近くに多臓器病変を認め、予後はリンパ節外臓器の病変数と相関する。頻度の多い臓器と症状を以下に示す。
-
皮膚(10%)
緩徐に増大する無痛性、非掻痒性の黄色〜赤色〜褐色の結節や丘疹を認める。多くは多発性で単発病変はまれである。全身の皮膚に発症しうる。リンパ節や他の臓器病変はほとんど認めない。
-
鼻腔/副鼻腔(10%)
鼻閉、鼻出血、鼻背変形、顔面非対称、耳閉塞感を認めるほか、口腔病変として、軟口蓋・硬口蓋の結節、歯肉・口腔粘膜の腫脹、舌の肥大、中咽頭粘膜の肥厚、扁桃腺の肥大、扁桃炎を認める。アジア系の患者に多く見られる。
-
眼(10%)
眼窩軟部組織、眼瞼、涙腺、結膜、角膜の腫瘤やぶどう膜炎、圧迫性の視神経障害などを認める。
-
中枢神経(5%)
75%が頭蓋内、25%が脊髄に発生する。頭痛、痙攣、歩行困難、四肢麻痺などの神経症状を伴い、通常は数週間から数か月かけて進行する。急速に進行し致死的な経過をたどる例もあるが、手術により切除できれば予後良好なことが多い。リンパ節病変を伴うことは稀である。
-
骨(5-10%)
骨幹端/骨幹に溶骨性または混合型(溶骨性/硬化性)の病変を生じ、軟部組織への進展をきたすこともある。しばしば骨痛を認めるが、病的骨折は稀である。ほとんどの例でリンパ節病変を伴う。
-
腎(4%)
孤発性の腫瘤またはびまん性の浸潤をきたし、血尿、蛋白尿、側腹部痛、腎不全、高カルシウム血症、ネフローゼ症候群のほか、水腎症や尿管閉塞が生じることもある。腎病変を伴うRDDは予後不良で、死亡率は約40%にのぼる。
-
肺(2%)
間質性肺疾患、肺結節、気管支疾患、胸水を生じ、慢性的な乾性咳嗽、進行性の呼吸困難、急性呼吸不全などの症状を認める。病勢が強く半数近くが死亡すると報告されている。ほとんどの例にリンパ節病変を伴う。
-
消化管(1%)
回盲部、虫垂、遠位結腸に好発し、ほとんどの例で病変が幽門より遠位に位置する。腹痛、便秘、血便、腹部腫瘤、腸閉塞など生じるが、無症状で大腸内視鏡検査や虫垂切除術後に発見されるケースもある。死亡率は約20%である。ほとんどの例はリンパ節病変や他の節外病変を伴い、中年女性に多い。
そのほか比較的まれな病変部位として、唾液腺、耳下腺、喉頭、咽頭、胸腺、甲状腺、心臓、肝臓、脾臓、膵臓、後腹膜、脊椎がある。
診断と検査
血液検査では、白血球増多、CRP上昇、赤沈亢進、フェリチン高値、IgG高値といった非特異的な炎症所見を認める。画像検査は全身のCT検査やMRI検査が病変の広がりを把握するために有用であり、FDG-PET/CT検査も推奨される。
RDDの診断は、症状や検査所見に加え、生検組織の病理組織検査により行われる。リンパ節の著しい腫大と拡張したリンパ洞内に大型の組織球が集簇した像を認める。組織球はS100, CD14, CD68, CD163陽性であるが、CD1a, CD207(ランゲリン)陰性であり、LCHとの重要な鑑別点となる。組織球の細胞質内にリンパ球を取り込むEmperipolesis(細胞内細胞貫入像)を様々な頻度で認める。また、IgG4陽性形質細胞を認めるが、RDDはIgG4関連疾患と比較しIgG4/IgG比が低い(<40%)。
治療と予後
単一臓器病変の予後は概ね良好であり、リンパ節または皮膚、骨に限局する例の20-50%は自然退縮する。よって、リンパ節限局型のうち病変の数が少ない例や、皮膚や骨に限局し無症状の例では、経過観察が推奨される。症状が問題となる場合にはステロイド剤の全身投与が行われる。上気道閉塞、脊髄圧迫、粗大病変による臓器障害をきたした例に対しては、外科的切除が行われる。
多臓器病変、特に肺、腎、消化管、肝病変を伴う症例は予後不良であり、全体の10%は死亡する。ステロイドと抗がん剤(ビンブラスチン、メソトレキセート、クラドリビン、クロファラビンなど)による化学療法を行う。化学療法で寛解が得られない難治例には、分子標的薬が検討される。本邦では、BRAF阻害剤であるダブラフェニブとMEK阻害剤であるトラメチニブの併用療法が、標準的治療が困難なBRAF遺伝子変異を有する進行・再発性の組織球性腫瘍に対し、2023年に保険収載された。ただし、BRAF V600E変異を伴う症例は5%未満と少数である。RASやMAP2K1変異を伴う症例に対しては、MEK阻害剤による分子標的療法が試みられる(保険適応外)10)。
参考文献
- Abla O, Jacobsen E, Picarsic J, et al. Consensus recommendations for the diagnosis and clinical management of Rosai-Dorfman-Destombes disease. Blood. 2018; 131: 2877-2890.
- Emile JF, Abla O, Fraitag S, et al. Revised classification of histiocytosis and neoplasms of the macrophage-dendritic cell lineages. Blood. 2016; 127: 2672-2681.
- Ferry JA, Hill B, Hsi ED. Mature B, T and NK-cell, plasma cell and histiocytic/dendritic cell neoplasms: classification according to the World Health Organization and International Consensus Classification. J Hematol Oncol. 2024; 17: 51.
- Bruce-Brand C, Schneider JW, Schubert P. Rosai-Dorfman disease: an overview. J Clin Pathol. 2020 ;73: 697-705.
- Younes IE, Sokol L, Zhang L. Rosai-Dorfman Disease between Proliferation and Neoplasia. Cancers (Basel). 2022; 14: 5271.
- Goyal G, Ravindran A, Young JR, et al. Clinicopathological features, treatment approaches, and outcomes in Rosai-Dorfman disease. Haematologica. 2020; 105: 348-357.
- Durham BH, Rodrigo EL, Picarsic J, et al. Activating mutations in CSF1R and additional receptor tyrosine kinases in histiocytic neoplasms. Nat Med. 2019; 25: 1839-1842.
- Chang L, Qiao B, Cai H, et al. Clinical phenotypes, molecular analysis, and outcomes of patients with Rosai-Dorfman disease. Leukemia. 2023; 37: 2297-2300.
- Hélias-Rodzewicz Z, Donadieu J, Terrones N, et al. Molecular and clinicopathologic characterization of pediatric histiocytoses. Am J Hematol. 2023; 98: 1058-1069.
- Asano T, Morimoto A, Nakazawa A, et al. Retrospective nationwide survey of pediatric RDD in Japan: a high prevalence of mutations in the kinase pathway genes. Int J Hematol. 2025; 122: 128-137.